行研聚焦 | 长期可植入左心室辅助设备的行业现状与技术历程
在现代医学领域,心力衰竭(HF)始终是一个严峻的挑战,它不仅严重影响患者的生活质量,更给医疗系统带来了沉重的负担。据最新数据,全球心力衰竭患者数量庞大,且发病率呈持续上升趋势。在中国,心力衰竭的发病率为1.3%,患病人数约1370万人,其中终末期心衰患者达130万人。每年有5%~10%的心力衰竭患者进展为终末期心力衰竭,而此阶段患者年死亡率高达50%。
面对如此严峻的形势,传统的心力衰竭治疗手段已难以满足患者的需求。药物治疗虽可缓解症状,但对于终末期心衰患者而言,其效果有限。而心脏移植虽是目前终末期心力衰竭最有效的治疗手段,但供体短缺严重制约了其发展,全球每年完成心脏移植仅6000例左右,远不能满足患者的需求。在此背景下,机械循环辅助(MCS)技术应运而生,它可部分或者完全替代心脏功能,已成为心力衰竭患者的重要治疗手段之一。
其中,长期可植入左心室辅助设备(LVAD)作为MCS的重要组成部分,近年来发展迅速,技术日趋成熟。它不仅可以为患者提供短期和中长期的循环支持,帮助患者渡过疾病危险期,还能作为心脏移植的过渡手段,甚至在某些情况下成为患者的终点治疗手段。本文将深入探讨长期可植入左心室辅助设备的行业现状、技术发展以及未来趋势,为相关领域的专业人士和关注者提供全面的行业研究视角。
心力衰竭简介
心力衰竭(简称心衰)是各种病因引起心脏结构和/或功能异常,进而导致心腔内压力升高、心输出量不足的一种临床综合征。
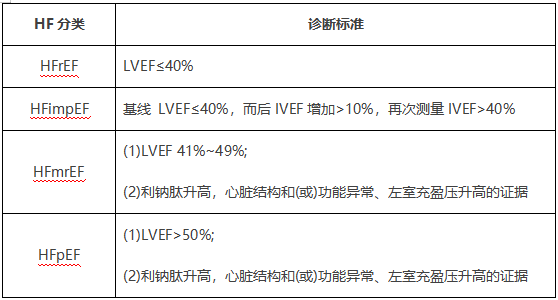
射血分数(Ejection Fraction, EF)是评估心脏收缩功能的重要参数,指心脏每次收缩时射出的血液量与收缩前心室容量的比值。根据2024年中国心力衰竭指南,心力衰竭按照左心室射血分数(LVEF)可分为以下四类,HF的分类具有广泛的适用性,不同类型HF发生的病理生理机制、治疗方案及预后均有所不同,临床医生通常根据不同类型的心衰选择最合适的治疗方案。
由于LVEF对心衰患者的药物治疗反应及预后至关重要,因此,根据LVEF对心衰患者进行分类有助于心衰患者诊疗方案的制定。
-
LVEF≤40%的心衰定义为射血分数降低的心衰(HFrEF);
-
LVEF在41%~49%的心衰定义为射血分数轻度降低的心衰 (HFmrEF);
-
LVEF≥50%的心衰定义为射血分数保留的心衰 (HFpEF)。
-
新增射血分数改善的心衰(HFimpEF)的定义,即基线LVEF≤40%,治疗后LVEF较基线增加≥10%,且再次测量LVEF>40%。
慢性心力衰竭的治疗包括药物治疗及器械治疗,药物治疗方面以肾素血管紧张素抑制剂、β阻滞剂及醛固酮受体拮抗剂为三大基石。器械治疗方面主要包含心脏再同步化治疗( CRT)及植入式心律转复除颤器( ICD) 等。
终末期心力衰竭自1967年世界首例心脏移植成功实施以来,经过五十余年发展,心脏移植成为目前终末期心力衰竭最有效的治疗手段。但供体短缺严重制约心脏移植发展,全球每年完成心脏移植仅6000 例左右,无法满足持续增长的终末期心力衰竭救治需求。机械循环辅助(MCS)经过50余年发展,技术日趋成熟,可部分或者完全替代心脏功能,已成为心力衰竭患者的有效治疗手段。
中国心血管病患病率处于持续上升阶段,心衰发病率为1.3%,患病人数约1370万人,其中终末期心衰患者达130万人。每年有 5%~10% 的心力衰竭患者进展为终末期心力衰竭,而此阶段患者年死亡率高达50%。
2022年收治HF住院患者(出院主要诊断或其他诊断包含HF且年龄≥18岁)的医院有5402家,其中三级医院2078家,二级医院3324家。上述医院共收治HF住院患者1029.0万人次,其中三级医院收治患者数量占61.0%,二级医院占39.0%。HF住院患者平均年龄为(71.0±12.7)岁,女性占44.6%。HF住院患者中,2.5%的患者在住院期间接受了机械通气治疗,0.3%接受了血液滤过治疗,0.2% 接受了主动脉内球囊反搏(IABP)治疗。HF 患者的住院死亡率为2.6%,非康复离院率为10. 2%,30d 再入院率为10.0%。
机械循环支持(mechanical circulatory support,MCS) 是代替或辅助心脏功能、向心外提供血液灌注、改善机体缺氧状态、促进器官功能恢复的人工器械,它可提供短期和中长期循环支持,帮助患者渡过疾病危险期、桥接心脏移植( bridge to heart transplant, BTT) 或长期循环支持治疗。 由于重症终末期心衰患病率的持续上升、药物治疗效果不佳、心脏移植供体不足及心功能受限所致生活质量的严重降低,使以心室辅助装置(ventricular Assist device,VAD)应用为主的MCS日渐成为终末期顽固性心衰患者的一种重要替代治疗手段。
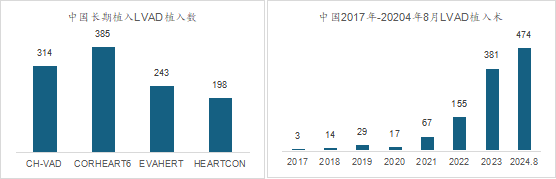
自2017年至2024年8月,全国154家医院累计植入人工心脏1140例。人工心脏的植入量每年持续增加。2022年机械辅助循环支持机构间登记处(INTERMACS)报告显示,2021年北美地区共登记2464例LVAD植入。2022年,北美共植入了2517个左心室辅助装置 (LVAD),其中 99.8% 是全磁悬浮装置。与以前的LVAD相比,第三代LVAD的1年和5年生存率分别提高到86%和64%。
机械循环辅助装置是心脏移植过渡期的首选方法,其植入途径有 3 种,分别是经皮介入、体外支持和体内植入。体内植入方式可分为心室辅助装置(ventricular assist device,VAD)和全人工心脏(total artificial heart,TAH),VAD 和 TAH 也被称为人工心脏。其中以左心室辅助装置(left ven⁃tricular assist device,LVAD)为代表,目前已经发展到第三代。VAD 在临床方面主要用于应用方向:1、移植前过渡支持(bridge to heart transplant,BTT);2、终点治疗 (destination therapy,DT);3、过渡到恢复或决策。LVAD获批适用历程如下:
- 1966年,DEBAKEY 等首次为 1 例患者植入了气动式LVAD。
- 1994年,美国食品药品监督管理局(FDA)首次批准了气动式 LVAD用于终末期心衰患者的心脏移植前辅助支持(BTT)治疗。
- 2001年发表的 REMATCH 研究结果显示,LVAD 可使不适合心脏移植的终末期心衰患者明显获益,由此,Heart-MateVE成为第一款被FDA 批准用于终点治疗,即永久替代治疗的 LVAD产品。
- 2008年,HeartMate II成为首款被FDA 批准用于BTT治疗的第二代LVAD。
- 2010年,FDA 批准将HeartMate II用于终点治疗。
- 2012年,新一代LVAD产品Heart-Ware HVAD被FDA 批准用于BTT治疗,但EN-DURANCE临床试验显示接受 Heart-Ware HVAD植入患者的不良事件发生率增加,最终其于2021年退市。
- 第三代LVAD产品 HeartMate3分别于2017、2018年被 FDA 批准用于 BTT 及终点治疗,MOMENTUM 临床试验显示 HeartMate3在BTT及终点治疗中的效果均优于 HeartMate Ⅱ。HeartMate3暂为目前唯一一款经 FDA 批准上市且在市的 LVAD产品。
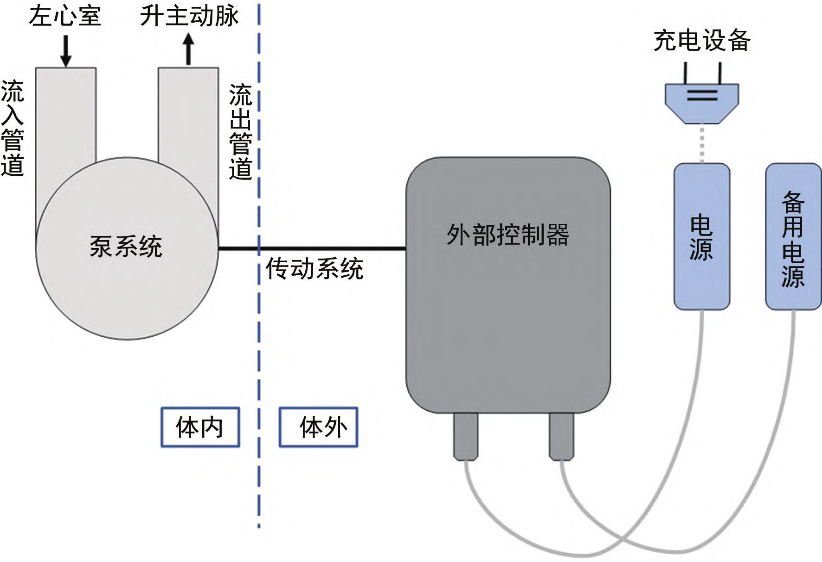
每种 LVAD 理论上均由以下几种组件组成:流入管道、泵系统、流出管道、传动系统、外部控制器、电源及充电设备(下图所示)。
- 流入管道同左心室相连接,接受来自左心的血液,通过泵系统将血液由流出管道泵回患者的升主动脉,从而部分或完全替代衰竭左心室的功能。
- 传动系统通常指连接泵系统及外部控制器的经皮电缆,它能为泵系统提供电力,同时在设定变更时向泵系统传递指令。
- 外部控制器本质上是一台小型计算机,用于控制并显示泵的各项参数,进行电力输送,并可在设备工作异常时进行警报。
- 电源及充电设备用于持续为 LVAD 提供动力,多 数LVAD使用锂电池供电,并配有备用电源。
第一代LVAD 为搏动流泵,,通过气动或电动的方式为患者提供脉冲式的血流,可较好地模拟心脏生理性泵血,有助于改善器官灌注和功能。泵进出口处设置有单向阀门,以保证血液的单向流动。常见的第一代 LVAD 有HeartMate VE、HeartMate XVE、Berlin Heart EXCOR及NovacorLVAS等,见下图。临床试验证明在终末期心衰患者中,LVAD 的治疗效果优于药物治疗。然而,第一代 LVAD 的体积大、噪音大,不良事件的发生率较高,患者生活质量欠佳。
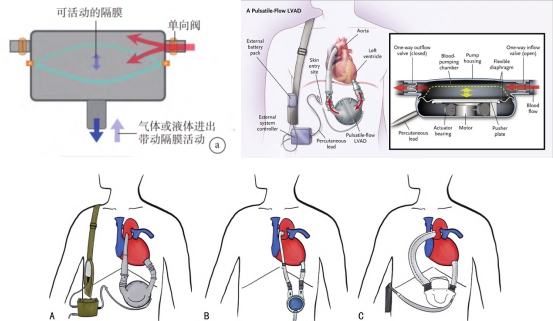
图. 第一代LVAD示意图:A: HeartMate XVE;B: Berlin Heart EXCOR;C: Novacor LVAS
Novacor是首款电动植入搏动性容积式人工心脏架,由于电动的驱动方式需要大量机械、电气结构作为支撑,Novacor的体积大,其结构如上图(c)所示,最大外径:高达160mm,重量为1kg,Novacor的泵室采用了圆形软聚氨酯袋,袋内置一个由直线电机驱动的拉板,电机往返运动压缩聚氨酯袋实现泵血。额定搏动频率为180次/min,额定出血量高达12L/min,泵室软聚氨酯袋可储存70ml的血液,于1998年获FDA批准,临床应用次数超过1800次,其植入患者体内的1年生存率为27%。
第二代LVAD 较第一代设计上更轻便、更具生物相容性,一般被称为轴流泵。其设计类似于机械水泵,叶轮转轴与血流方向平行,利用叶轮旋转形成持续血流。通过集成无阀轴向泵与可变磁场的设计,泵的叶轮得以快速旋转,从而产生平行于旋转轴的连续血流。轴流泵无需瓣膜及泵室,仅有1个活动部件即转子,此种设计提高了设备耐用性,明显降低了噪音,同时减少了不良事件的发生。常见的第二代 LVAD有HeartMateⅡ、Jar-vik2000及DeBakeyVAD等,见下图。第二代LVAD的机械轴承仍与血液直接接触,血细胞可能被轴承碾压而破碎,增加了血栓形成的风险。
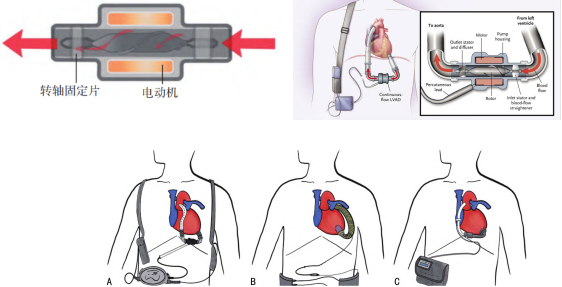
图.第二代LVAD示意图:A:HeartMateⅡ;B: Jarvik 2000;C: DeBakey VAD
HeartMateⅡ是由前Thoratec公司研制的首款第二代轴流泵,如下图所示,采用永磁无刷直流电机驱动转子带动叶轮旋转,转子由轴承支承。HeartMateⅡ的结构很小,整体尺寸为40x60mm,重量仅375g。叶轮额度转速高达15000r/min,可为心衰患者提供3-10L/min的心输出。控制器的可视化界面可以直接显示电机转速、心输出、功率、脉动指数等关键参数。泵体表层采用了医用钛合金,部分表面掺杂着粗糙材料,可以改善生物相容性。在植入体内时,HeartMateⅡ的入口导管跟受损心脏的左心室尖端连接出口导管跟主动脉链接,于2008年获得FDA批准。截至目前全世界超过一万名心血管患者采用了该设备,是应用最成功的人工心脏泵之一,使用1年和2年的平均存活率分别为74%和61%。但是根据对众多植入用户的跟踪调查,HeartMateⅡ长期使用后依旧存在溶血、血栓、主动脉瓣融合、肠胃出血等问题。
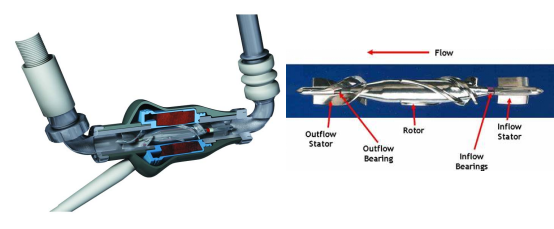
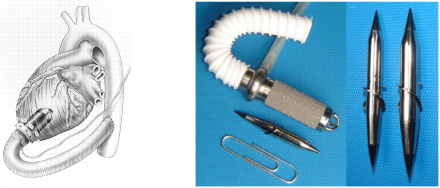
美国JarvikHeart公司研发的Jarvik 2000也是一种植入式轴流栗,根据不同年龄阶段开发出成人版和儿童版两款产品。Jarvik 2000突出的特点是尺寸极小,如图所示,其成人版的尺寸是25x55m,重量为85g。
Jarvik 2000儿童版产品的尺寸更小,泵内血液容量仅有4mL,重量不到15g, 但能满足儿童的血流量需求。Jarvik 2000的泵壳采用医用钛合金材料,出入口导管采用编织材料,泵室内置有微型直流电机、用于支承转子的陶瓷轴承以及转子叶轮。Jarvik 2000的工作转速范围是8000-12000r/min,共分5个转速档位,可提供3-7L/min的心输出。值得一提的是,Jarvik 2000的控制器有独特的间歇低速模式,即每隔一个周期均会触发叶轮降速8s的指令,可制造规律喷射的效果,从而减少血栓的发生概率。体积小的特点让Jarvik 2000在患者植入时和植入后体验更佳,排斥反应明显减少,目前Jarvik 2000并已获CE批准用于临床治疗。
第三代LVAD为磁液悬浮泵, 设计上采用磁悬浮或液力悬浮技术, 同脉动泵依靠叶轮驱动,包括磁悬浮、磁液悬浮、水悬浮等类型。叶轮与血泵无直接接触,主动或被动地使叶轮悬浮于泵体中。可使用更低的转速产生足够的连续离心血流,具有更高的泵血效率。第三代 LVAD同血液的接触面进一步减小,血流间隙更宽,设备对血液成分的破坏明显减少。同时,体积的进一步减小使得泵体可被放置于心包腔内。
相对于轴流泵,离心泵叶轮无传统的转轴结构,同时效率更高,因而可以减慢叶轮转速,减轻对血细胞的破环。部分品牌离心泵还能够通过控制系统实现“脉搏”效果,进而起到冲刷作用。
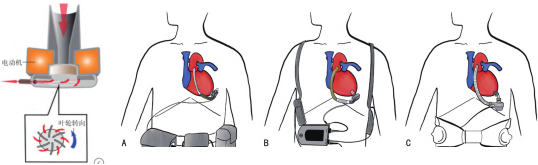
图.第三代LVAD示意图:A: HeartWare HVAD; B: HeartMate 3; C: EVAHEART
HVAD是一款综合液力悬浮和磁悬浮技术的混合悬浮离心式人工心脏泵,如下图所示,其尺寸为48x28mm,重约160g,转速在1800-4000r/min可调,流量最高可达10L/min。
HVAD液力悬浮时存在间隙较小的情况(约40μm),会产生高剪切应力,极大地影响血泵的血液相容性。一项针对HVAD的临床试验将其与第二代人工心脏泵HeartMate II进行了比较,结表明两款产品的医疗效果相差不大,HVAD在血液相容性上甚至稍逊一筹,其中脑卒中率为29.7%,HeartMate II仅为12.1%,但在设备故障率方面HVAD更低。后续开发出HVAD的改进版本MVAD,与上一代相比,MVAD由离心泵改为体积更小的轴流泵,尺寸仅为HVAD的2/3,其优势体现在微型的泵体结构尺寸及超宽的转子调速范围1600-28000r/min。

- 越来越多的观察性临床研究表明,与患者可以获得的其他循环辅助装置相比,HVAD导致的神经损伤不良事件——包括脑中风的发生率、死亡率更高;
-
HVAD血泵在因掉电而停转情况下可能无法重新启动,或无法立即重新启动,导致危及生命的严重后果。
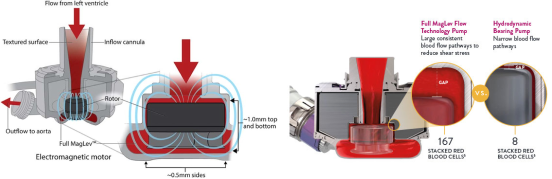
HeartMate III的结构包括泵体、驱动电机和叶轮,其中驱动电机的转子和叶轮通过装配组合到一起。电机的主体是8组L型铁芯,上面布置有转矩绕组和悬浮绕组。转子在径向上的2个自由度有悬浮绕组通电进行控制,在轴向上的另外3个自由度则依靠定转子间存在的磁拉力完成被动悬浮。,其工作时泵内叶轮凭借磁悬浮技术完成稳定悬浮,能够使叶轮与泵内壁留有较宽的血流通道(侧边0.5mm,上下1mm),可以大大降低并发症的发生概率,这点相比于HVAD具有较大优势。
于2017 年获批用于 BTT,2018年获批用于DT。 该装置的转速为2 000~ 5 500 r/min,提供的心输出量最大可达10 L/min,其植入容积为 50 ml,质量为 281 g。HeartMate III的设计大大减少了 LVAD 相关的不良事件,人工脉冲防止了血液淤滞,同时其转子非接触式旋转可消除发热和磨损。
通过本文的介绍,我们对心力衰竭的严峻形势以及长期可植入左心室辅助设备(LVAD)的发展历程和现状有了一定的了解。从第一代搏动流泵到如今第三代磁悬浮泵,LVAD技术的每一次进步都为心力衰竭患者带来了新的希望。然而,LVAD技术的发展并非一帆风顺,从第一代的体积大、噪音大、不良事件发生率高,到第二代的血栓风险,再到第三代技术中仍需解决的悬浮性能、血液相容性等问题,都提醒着我们技术创新之路的艰辛。
在接下来的内容中,我们将继续深入探讨LVAD的核心部件及评价指标,包括电机、生理控制、血液相容性以及体外设计及实验验证等方面。这些内容将帮助我们更全面地了解LVAD的技术细节和性能表现,为未来的研究和临床应用提供有力的支持。
参考资料:
[1] 董念国:慢性心衰及终末期心脏病2023年进展
[2] 陈静,吴明祥,苏晞.终末期心力衰竭机械循环支持的治疗进展[J].中国心血管杂志,2024,29(01):17-26.
[3] Virani SS, Alonso A, Aparicio HJ, et al. Heart disease and stroke statistics-2021 update: a report from the American Heart Association[J]. Circulation, 2021, 143(8): e254-e743.
[4] 刘明波,何新叶,杨晓红,等.《中国心血管健康与疾病报告2023》要点解读[J].中国心血管杂志,2024,29(04):305-324.
[5] 严道医声网:左室辅助装置在晚期心力衰竭中的应用
[6] 罗渝翔,吴庆琛,帖红涛.左心室辅助装置的发展历程、并发症及未来展望[J].重庆医学,2024,53(09):1391-1396.
[7] Zeitler EP, Cooper LB, Clare RM, Chiswell K, Lowenstern A, Rogers JG, Milano CA, Schroder JN, Al-Khatib SM, Mentz RJ. OptiVol for Volume Assessment in Patients With Continuous Flow Left Ventricular Assist Device. ASAIO J. 2021 Feb 1;67(2):192-195.
[8] 刘鑫.混合磁悬浮人工心脏泵设计优化与生理控制研究[D].中国科学技术大学,2024.
[9] 伟波.轴流式磁悬浮锥形血泵的设计与性能研究[D].武汉理工大学,2022.
[10] 曹俊波. 磁液双悬浮轴承多自由度解耦与抗干扰控制研究[D]. 燕山大学,2020.
[11] Chen G, Yao L, Zheng R, et al. Design and Implementation of a N ovel Passive Magnetically Levitated N utation Blood Pump for the Ventricular-assist Device[J]. IEEE Access, 2019, 7: 169327-169337.
[12] .罗基平,黄典贵 上一个: 新竞品入场!脊柱运动保留战局重构 下一个: 行研聚焦 | 长期可植入左心室辅助设备的关键部件与评价指标


